"光敏素對種子發芽率影響" 修訂間的差異
(已建立頁面,內容為 "<font size="6">光敏素對種子發芽率影響</font> <s4e> pid=194 show=原始設計者;簡介 </s4e> <div style="float:left;"> <font color="red" size="5">探討…") |
|||
| 行 32: | 行 32: | ||
==1.現象說明: == | ==1.現象說明: == | ||
| − | |||
1.光敏素(phytochrome) | 1.光敏素(phytochrome) | ||
| 行 38: | 行 37: | ||
植物細胞中含量稀少的藍綠色素,成分為蛋白質,分為鈍化型(proteinred, Pr)和活化型(proteinfar-red, Pfr)兩種型態,分別吸收紅光和遠紅光而互相轉換。植物主要透過光敏素接收外界光的信號來調節本身的生長、發育和開花。過去知道在晚上,Pfr構形的光敏素會慢慢回到Pr構形;這個過程稱為黑暗回復(dark reversion) | 植物細胞中含量稀少的藍綠色素,成分為蛋白質,分為鈍化型(proteinred, Pr)和活化型(proteinfar-red, Pfr)兩種型態,分別吸收紅光和遠紅光而互相轉換。植物主要透過光敏素接收外界光的信號來調節本身的生長、發育和開花。過去知道在晚上,Pfr構形的光敏素會慢慢回到Pr構形;這個過程稱為黑暗回復(dark reversion) | ||
| − | |||
<img style="width:500px;" src='https://upload.wikimedia.org/wikipedia/commons/2/24/Phytochrome_Pr_Pfr.png'/> | <img style="width:500px;" src='https://upload.wikimedia.org/wikipedia/commons/2/24/Phytochrome_Pr_Pfr.png'/> | ||
| − | + | ||
</table> | </table> | ||
<br> | <br> | ||
| + | 2.光敏素的作用 | ||
| + | <br> | ||
| + | *2.1光週期性植物的開花誘導 | ||
| + | <br> | ||
| + | :*Pfr < Pr 促進短日照;抑制長日照 | ||
| + | <br> | ||
| + | :*Pfr > Pr 抑制短日照;促進長日照 | ||
| + | <br> | ||
| + | *2.2 種子的萌發 | ||
| + | <br> | ||
| + | :*Pfr 促進感光性種子萌發 | ||
| + | <br> | ||
| + | :*Pr 抑制感光性種子萌發 | ||
| + | <br> | ||
| + | *2.3 幼苗的生長 | ||
| + | <br> | ||
| + | :*Pfr促進葉綠素、胡蘿蔔素、花青素合成;葉綠體的形成;子葉、葉、莖的生長 | ||
| + | |||
於 2020年8月6日 (四) 18:41 的修訂
光敏素對種子發芽率影響
原始設計者:彰師大
探討光敏素 Pr、Pfr對好光性植物種子萌發的關係。
實驗材料:
- 苜蓿芽種子 20粒
- 培養盤 4個
- 厚紙巾 4張
- 水 適量
- 鋁箔 8張
- 手電筒 2個
- 紅色透明玻璃紙 2張
- 藍色透明玻璃紙 4張
- 綠色透明玻璃紙 1張
- 紅色透明玻璃紙 2張
1.現象說明:
1.光敏素(phytochrome)
2.光敏素的作用
- 2.1光週期性植物的開花誘導
- Pfr < Pr 促進短日照;抑制長日照
- Pfr > Pr 抑制短日照;促進長日照
- 2.2 種子的萌發
- Pfr 促進感光性種子萌發
- Pr 抑制感光性種子萌發
- 2.3 幼苗的生長
- Pfr促進葉綠素、胡蘿蔔素、花青素合成;葉綠體的形成;子葉、葉、莖的生長
3.實作項目
- 1.萃取DNA
- 1. 取10粒米切取胚芽部分放入研缽。
加BashingBead buffer 750 ul研磨。(打破細胞)
- 2. 移入BashingBead tube。
加Proteinase K 1 ul。(分解蛋白質)
65 ℃ 水浴 10 min。
10,000 rpm 離心 1 min。(移除雜質)
- 3. 取上清液500 ul加入III-F filter+ collection tube。
- 3. 取上清液500 ul加入III-F filter+ collection tube。
8,000 rpm 離心 1 min。(過濾雜質)
- 4. 移除III-F filter。
- 5. 在collection tube中,加入Lysis buffer 1500 ul。(打開DNA+準備Binding)
和過濾液充分混合。
- 6. 取混合液 800 ul。(DNA Binding在膜上)
- 6. 取混合液 800 ul。(DNA Binding在膜上)
加入II-C column+ collection tube。
10,000 rpm 離心 1 min。
- 7. 倒掉濾液。
- 7. 倒掉濾液。
重複step 6兩次。
- 8. 把II-C column移至新的collection tube。
- 8. 把II-C column移至新的collection tube。
加入Pre-wash buffer 200 ul。(去除糖類、蛋白質)
10,000 rpm 離心 1 min。
- 9. 倒掉濾液。
- 9. 倒掉濾液。
加入Wash buffer 500 ul。(去除糖類、蛋白質)
10,000 rpm 離心 1 min。
- 10. 把II-C column移至新的eppendorf。
加入Elution buffer 20 ul。(回溶DNA)
10,000 rpm 離心 30 sec。
- 11. 取HRC-filter+ collection tube。
- 11. 取HRC-filter+ collection tube。
加入Prep solution 600 ul。
8,000 rpm 離心 3 min。
- 12. 把HRC-filter移至新的eppendorf。(去除酚類)
- 12. 把HRC-filter移至新的eppendorf。(去除酚類)
加入剛剛Elute的DNA 20 ul。
15,000 rpm 離心 3 min。
- 13. 標上組別, -20 ℃保存。
- 14. 測DNA濃度(NanoDrop)
- 15. 跑2%電泳
- 跑PCR
- 1. PCR 試劑配置-四要素
- 1. PCR 試劑配置-四要素
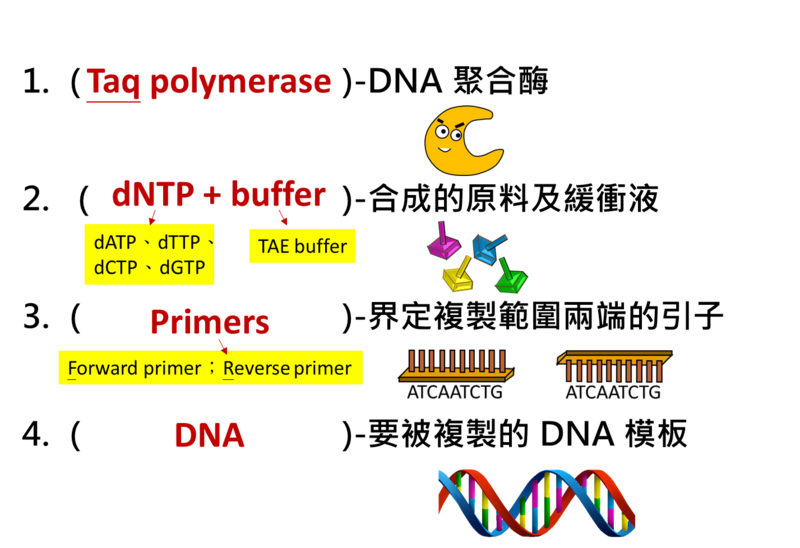
Taq polymerase最適合的extension溫度是72℃
- 2. PCR 試劑配置
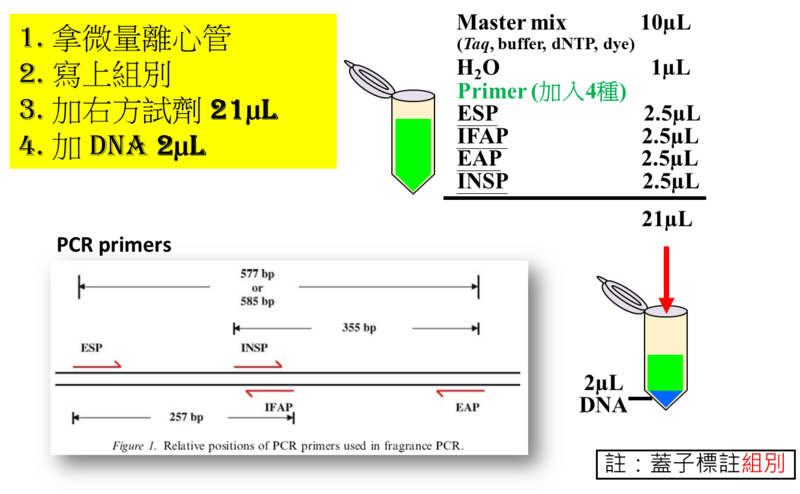
- 3. PCR 條件


- 4. 電泳跑膠

4.分析與結論
- 4.1 從萃取DNA膠圖中判斷是否有抽出DNA。
- 4.2 從PCR膠圖中判斷樣本是BAD2基因是否正常,並判斷是否與預期結果相同。
- 4.3 若PCR膠圖有585bp和355bp兩條bands,則代表此為純品系一般米DNA;若膠圖中有577bp和257bp兩條bands,則為純品系香米DNA;若同時具有585bp、355bp和257bp,則為異型合子的一般米。
5.教學目標與評量
- 5.1 了解香米具有香氣的原因是由於BAD2的缺損。
- 5.2 能熟悉DNA萃取的操作方式。
- 5.3 能從Nano drop的結果判斷DNA品質好壞。
- 5.4 熟悉PCR和電泳的操作方式。
- 5.5 能從PCR膠圖判斷樣品的種類。
6.參考資料:
7.參考說明:
- 萃取DNA膠圖

- PCR膠圖

