"Rutherford與亞佛加厥常數" 修訂間的差異
| 行 79: | 行 79: | ||
::::::::::::::<img style="https://upload.wikimedia.org/wikipedia/commons/f/ff/%E4%BA%9E%E4%BD%9B%E5%8A%A0%E5%8E%A5%E6%95%B8-18.png'/> | ::::::::::::::<img style="https://upload.wikimedia.org/wikipedia/commons/f/ff/%E4%BA%9E%E4%BD%9B%E5%8A%A0%E5%8E%A5%E6%95%B8-18.png'/> | ||
::以132 d數據計算,得式[6]。 | ::以132 d數據計算,得式[6]。 | ||
| − | ::::::::::::::<img style="https://upload.wikimedia.org/wikipedia/commons/b/b3/%E4%BA%9E%E4%BD%9B%E5%8A%A0%E5%8E%A5%E6%95%B8-19. | + | ::::::::::::::<img style="https://upload.wikimedia.org/wikipedia/commons/b/b3/%E4%BA%9E%E4%BD%9B%E5%8A%A0%E5%8E%A5%E6%95%B8-19.png'/> |
於 2020年3月31日 (二) 13:28 的修訂
原始設計者:彰師大
|
介紹二十世紀初利用兩組拉賽福(Ernest Rutherford, 1871 – 1937)的實驗數據,分別是在1908年的α射線的鐳-226
|
|
1.現象說明
亞佛加厥常數
 的準確數值為
的準確數值為
 ,
12公克的碳-12含有
,
12公克的碳-12含有
 個碳原子。雖然
個碳原子。雖然
 的數值對於化學家至為重要,但是其準確值的獲得是相當近代的事。一個世紀以前的科學家們在準確度偏低的測量數據中,是如何推演出亞佛加厥常數的呢?
的數值對於化學家至為重要,但是其準確值的獲得是相當近代的事。一個世紀以前的科學家們在準確度偏低的測量數據中,是如何推演出亞佛加厥常數的呢?
2.探究問題
- 2.1 亞佛加厥常數的計算方法。
- 2.2 根據實驗「鐳-226輻射α粒子的速率」與「從鐳生產氦」所得數據計算亞佛加厥常數。
- 2.3 比較實驗所推得的亞佛加厥常數與準確值。
3.實作項目
- 3.1 閱讀關於拉賽福的實驗之說明
- 鐳-226輻射α粒子的速率:
- 在1908年,拉賽福和蓋格(Johannes Wilhelm "Hans" Geiger, 1882 – 1945)發表
 輻射α粒子的速率,他們的實驗裝置如圖一所示:
輻射α粒子的速率,他們的實驗裝置如圖一所示:
- 圖一之右是偵測器(detecting vessel),抽氣至低壓(2-5 cm Hg)。A是包覆於電池正極的管柱,B是一條連到電池負極的電線,外加電壓。被α粒子游離的氣體,會將電流訊號放大數千倍傳到B為硬橡皮塞,D是讓α射線通過的小孔,直徑為數毫米,孔上裝有薄雲母片(將α粒子減速)。E為長玻璃管,輻射源可放置在距C不同長度的位置。F是活塞活栓,打開後α粒子可穿透到偵測器,G是磨口玻璃塞。
- 我們將鐳-226
 的主要衰變路徑及其半衰期列於表一。
的主要衰變路徑及其半衰期列於表一。

- (資料來源:https://en.wikipedia.org/wiki/Radium)
- 表一 的主要衰變路徑及其半衰期
- (資料來源:https://en.wikipedia.org/wiki/Radium)
- 從鐳-226
 衰變到比較穩定的鉛-210
衰變到比較穩定的鉛-210 過程中,共有4個反應會放出α粒子,有3個反應會放出γ射線。拉賽福和蓋格將
過程中,共有4個反應會放出α粒子,有3個反應會放出γ射線。拉賽福和蓋格將 從暴露在大量
從暴露在大量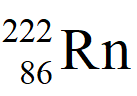 數小時之後的固體移開,靜置十五分鐘之後
數小時之後的固體移開,靜置十五分鐘之後 幾乎完全衰變,所測得的α粒子幾乎都是從
幾乎完全衰變,所測得的α粒子幾乎都是從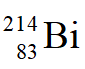 的β衰變後立即由
的β衰變後立即由 產生。實驗測量10分鐘內衰變的α粒子數,並同時在上圖的垂直方向以另一個相似的偵測器測量樣品的γ射線強度。儀器只能量到能量較高的γ射線,由
產生。實驗測量10分鐘內衰變的α粒子數,並同時在上圖的垂直方向以另一個相似的偵測器測量樣品的γ射線強度。儀器只能量到能量較高的γ射線,由 產生的γ射線。將測量得到的γ射線強度與處於「放射性平衡」(radioactive equilibrium)的
產生的γ射線。將測量得到的γ射線強度與處於「放射性平衡」(radioactive equilibrium)的 標準品的γ射線強度作比較,推算出樣本的相對
標準品的γ射線強度作比較,推算出樣本的相對 質量,再算出每單位時間單位質量釋放的α粒子數。
質量,再算出每單位時間單位質量釋放的α粒子數。 - 在拉賽福的時代,
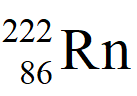 稱為”radium emanation”(蒸散後的鐳),
稱為”radium emanation”(蒸散後的鐳),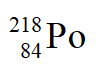 、
、 和
和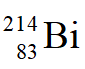 分別稱為”radium A”、”radium B”及”radium C”。
分別稱為”radium A”、”radium B”及”radium C”。 - 讓α射線通過的小孔(D)直徑為1.25 mm,輻射源距離小孔150 cm,10分鐘內偵測器量到45個α粒子,輻射源對應於0.55微克的
 。
。
- 3.2 試將以上拉賽福實驗裝置繪於一圓,並計算出每單位時間單位質量釋放的α粒子數(參考答案如式[2]所示)
- 3.3 閱讀關於拉賽福的實驗之說明 (從鐳生產氦):
利用前述的電流訊號放大偵測法,拉賽福等人於1911年以γ射線強度測得實驗中鐳的質量為0.192 mg,經過83天後共產生6.58 mm3的氦,經過132天後共產生10.38 m3的氦(1 atm, 0℃ )。
從 衰變到比較穩定的
衰變到比較穩定的 過程中,共有4個反應會放出α粒子,和α粒子實驗不同的是,實驗以鐳的鹽類(RaBr2)進行,因此表一所列的其他放射性物質的濃度為零。以實驗時間132天來看,表一中的第三和第四個α粒子輻射反應可以視為處於放射性平衡,第一個α粒子輻射反應極為緩慢,其反應速率可視為常數。若每天由
過程中,共有4個反應會放出α粒子,和α粒子實驗不同的是,實驗以鐳的鹽類(RaBr2)進行,因此表一所列的其他放射性物質的濃度為零。以實驗時間132天來看,表一中的第三和第四個α粒子輻射反應可以視為處於放射性平衡,第一個α粒子輻射反應極為緩慢,其反應速率可視為常數。若每天由 釋放的α粒子所產生的氦氣體積為x,則其他三個α粒子輻射反應所產生的氦氣體積應小於y = 3x。在反應的第T天,氦氣的體積如式[3]所示:
釋放的α粒子所產生的氦氣體積為x,則其他三個α粒子輻射反應所產生的氦氣體積應小於y = 3x。在反應的第T天,氦氣的體積如式[3]所示:
- 在式[3]中的第一項是由
 產生的的氦氣體積,第二項是
產生的的氦氣體積,第二項是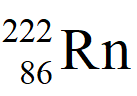 每天α粒子輻射產生氦氣的三倍體積,積分式[3]得,
每天α粒子輻射產生氦氣的三倍體積,積分式[3]得, 是
是 的α衰變速率常數,因為
的α衰變速率常數,因為 ,以實驗的天數,積分中的
,以實驗的天數,積分中的 趨近於零,因此式[3]可以近似,如式[4]所示:
趨近於零,因此式[3]可以近似,如式[4]所示:
- 將83 d 和132 d帶入分別得到3.801x和3.875x,也就是應得的氦氣體積和x的倍數關係。以83d數據計算,得式[5]。
- 以132 d數據計算,得式[6]。
4.分析與結論
- 4.1 檸檬酸溶解於水: 檸檬酸的分子式為 C6H8O7 ,結構為
- 4.1.1 檸檬酸分子溶解於水後,最多可能會釋放三個質子,你能看出是哪三個嗎?
- 4.1.2 檸檬酸分子溶解於水後,水溶液溫度下降,這代表能量消失了嗎? 從前述的分子動力學模擬影片,說明水分子的運動發生何種變化。
- 4.1.3 水溶液溫度下降,和水溶液中的水分子及陰、陽離子的運動有何關係?
- 4.1.4 這個反應是「吸熱反應」或是「放熱反應」?
- 4.1.5 試述反應過程能量的流動,水的運動在反應前後的變化。
- 4.1.6 搜尋課本和網路,有沒有溶於水為放熱反應的酸?
- 4.2 克潮靈溶解於水: 克潮靈的主要成分為 CaCl2
- 4.2.1 寫出其溶解反應式。
- 4.2.2 CaCl2溶解於水後,水溶液溫度上升,這代表能量增加了嗎? 從前述的分子動力學模擬影片,說明水分子的運動發生何種變化。
- 4.2.3 水溶液溫度上升,和水溶液中的水分子及陰、陽離子的運動有何關係?
- 4.2.4 CaCl2溶解於水的過程可視為以下幾個反應的總合,第一個反應為固體「晶格能」,另外兩個反應是「水合能」,計算溶解反應的反應熱。
- 4.2.5 試述此反應過程能量的流動,水的運動在反應前後的變化。
- 4.2.6 搜尋課本和網路,有沒有溶於水為吸熱反應的鹽類?
5.教學目標與評量
- 5.1 能從實驗後溶液的溫度變化,判斷化學反應為吸熱或放熱反應。
- 5.2 能知道能量有不同的形式,包括晶格能、水合能、分子轉動和振動的能量。
- 5.3 能知道水吸熱且水溫上升時,放熱反應釋放的能量轉換為溶液分子的轉動和振動。
6.參考資料
- 6.1 參考文獻
- [1] 水的轉動與振動模擬 : https://www.youtube.com/watch?v=IGEP-u1PNX0
- [2] 溶解 : https://zh.wikipedia.org/wiki/%E6%BA%B6%E8%A7%A3
- 6.2 進階知識
- 6.2.1 反例: 不同於檸檬酸,鹽酸(HCl)溶於水是放熱反應。
- 6.2.2 反例: 不同於CaCl2,NaCl 溶解於水是吸熱反應。
- 6.2.3 電負度: 電負度 (electronegativity),也稱負電性或陰電性,每一個原子都有其特有的,大於零的電負度數值。電負度越大的原子,在與另一原子鍵結時吸引電子的傾向越強,越具有局部負電,鍵結的另一端則帶局部正電。分子內的局部正負電分布越明顯,越容易包覆陽離子或陰離子。
- 電負度順序: F> O > N, Cl > Br > S > I > C > P > H




