以Excel程式模擬化學平衡
藉由Excel程式模擬反應物及產物與時間的關係,經由改變各種實驗條件,了解化學平衡(chemical equilibrium)的內涵。化學反應達平衡時正反應速率等於逆反應速率,且平衡常數等於逆反應速率常數除以正反應速率常數。
1.現象說明
在學習化學平衡的過程中,學習者接觸的核心概念包括正、逆反應速率常數、反應級數等。Excel程式是學習反應速率的最佳工具,因為我們可以引入「一段極短時間」的概念,改變反應條件進行探索,計算濃度與時間、反應速率與時間、反應商 (reaction quotient, Qr) 與時間的關係。
2.探究問題
利用Excel程式,改變實驗條件,包括反應物濃度、反應級數、反應速率常數,讓學習者深入了解化學平衡的內涵。教師可視時間多寡,使用電腦教室讓同學一次或分次自行完成Excel程式,或讓同學使用已完成的程式。過程中探究:
- 2.1 反應速率應如何定義? 反應物與產物的濃度如何表示?
- 2.2 如何在Excel中計算反應速率?
- 2.3 反應商如何隨時間改變,是漸增或漸減呢?
- 2.4 反應商不再改變時,其值等於平衡常數嗎?
- 2.5 平衡常數有沒有單位?
3.實作項目
- 3.1 設定「時間差」(t)及「時間軸」,設一基元反應(elementary reaction) 為
- 基元反應的分子係數即為反應級數,因此正、逆反應速率分別為
- 反應物與產物之濃度與時間的關係分別為


- 正、逆反應速率(rate[for] 、rate[back])與時間之關係如下:
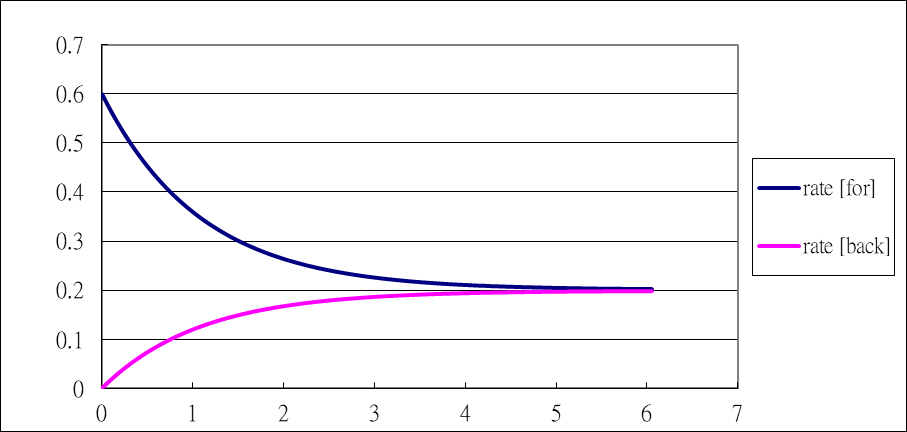
- 可以看出,反應時間約 6 sec 時正、逆反應速率相等。反應商定義為
- 反應商與時間之關係如下:


- 3.2 影響反應達平衡所需時間之因素(正、逆反應皆為一次反應) :
- 3.2.1 改變反應物起始濃度 :
 : [A] 、[B] 與時間之關係圖,正、逆反應速率與時間之關係圖,反應商與時間之關係圖分別為
: [A] 、[B] 與時間之關係圖,正、逆反應速率與時間之關係圖,反應商與時間之關係圖分別為
 :
:

- 在[A] 、[B] 與時間之關係圖及正、逆反應速率與時間之關係圖中,所有的數據都是原反應條件的兩倍,反應商與時間之關係圖則和原反應條件數據相同。
- 3.3 影響反應達平衡所需時間之因素(正反應為二次反應、逆反應為一次反應) :
- 3.3.1 反應物起始濃度分別為
 及 ,反應商與時間之關係圖分別為
及 ,反應商與時間之關係圖分別為

- 起始濃度低時,達平衡所需時間較長。
- 3.3.2

- 對於平衡常數相同的反應,正、逆反應速率較大時達平衡所需時間較短。
- 3.4 影響反應達平衡所需時間之其他因素:
- 學生試寫出其他可設定的參數 ,整理出影響平衡時間的因素 。
4.分析與結論
- 4.1 影響平衡所需時間的因素(起始濃度):
- 4.2 影響平衡所需時間的因素(速率常數):
5.教學目標與評量
- 5.1 能實際撰寫Excel程式、從數據、繪製圖表 。
- 5.2 能從圖表或的結論,並能合理化解釋 。
- 5.3能了解「化學平衡」之意涵,化學反應平衡時正、逆反應仍然持續進行,正、逆反應速率相等。
- 5.4化學平衡時正、逆反應速率相等,反應商達固定值,即平衡常數。
6.參考資料
- 6.1參考文獻
- [1] 化學平衡: https://en.wikipedia.org/wiki/Chemical_equilibrium
- [2] 平衡常數: https://en.wikipedia.org/wiki/Equilibrium_constant